來源: 點擊:1693 喜歡:0
2016-11-01 08:24:58 來源: 點擊:
1 引言“紅水”問題一直是供水管網研究與關注的焦點, 而引發“紅水”的因素眾多, 過程復雜, 機理尚未明確.供水管網“紅水”的出現會嚴重影響人們的生活和工業生產, 這是供水企業一直想要解決的問題.眾多學者對“紅水”形成的原因開展了大量的研究, 其中, 水源切換是引起給水管網“紅水”最主要的因素之一, 通常認為, 無內襯的鐵質管材在長時間輸配水之后, 在管道內壁會形成較為穩定的管垢層, 能夠防止水對管壁金屬的繼續腐蝕.而當切換水源時, 如果新水源的水質與原水源差別較大, 管垢與原水間的平衡就會被打破, 導致鐵溶出釋放到水中形成“紅水”;另一方面, 新水源會繼續對基體管壁金屬進行電化學腐蝕產生Fe2+, Fe2+在水中被氧化形成Fe3+及其氧化物或氫氧化物, 而Fe2+也可以與CO32-形成碳酸亞鐵, 這些腐蝕產物會導致“紅水”的發生.水質參數如pH、余氯、堿度、硬度、溶解氧、水質的陰陽離子濃度等也是影響鐵釋放產生“紅水”的重要因素, 不同水質參數對鐵溶出釋放的作用也有所不同, 高pH值有助于鐵溶出物在管壁上沉積形成致密的管垢層, 并且可以有效減少鐵釋放;而低pH值會將使管垢層呈現疏松多孔狀結構, 促進了鐵的溶解.而在固定pH下, 鐵腐蝕速率一般隨著總堿度的升高而降低;硬度通常與堿度有關, 高堿度的水通常具有較高硬度, 高硬度的水通過形成CaCO3和Mg(OH)2增加了管垢的厚度, 抑制鐵的溶出.管網中水的流態也會對“紅水”的形成有一定的貢獻, 在管網中, 水流的狀態一般可以分為兩種, 即單向流(如枝狀管網或末端管段)和循環流(如環狀管網).Vreeburg等認為, 由于流速的不同水中鐵溶出顆粒物的狀態與沉淀趨勢也不同, 當流速超過0.06 m·s-1時.管壁上沉積的顆粒物有向水中釋放的趨勢, 而當流速小于0.06 m·s-1時, 水中的顆粒物則有向管壁沉積的趨勢.“紅水”現象和進入到管網的顆粒物有關, 這些顆粒物的體積、密度及來源都不相同, 其中, 一些顆粒物來自水源本身經過漫長的累積沉淀在管壁上;一部分來自管網管材本身, 主要與管道內壁的腐蝕與結垢等因素有關.水的化學穩定性對“紅水”的形成有也有這一定的影響, 不同水源水質的化學穩定性指數也差異較大, 通常飲用水的拉森指數小于1, 腐蝕性較為微弱, 易形成穩定的管垢;再生水及海水淡化水拉森指數大于1, 腐蝕性較強, 不易形成管垢, 容易出現“紅水”.再生水主要是以城市污水處理廠二級出水作為原水, 經過再生工藝處理得到的水.再生工藝為常規的混凝沉淀過濾工藝和膜分離工藝.其中, 通過反滲透膜生產的再生水離子含量少, 其水質和自來水有很大的區別, 更接近純水.再生水和自來水在輸水管網中會有不同的水質穩定性.目前, 國內外對自來水的輸配管網研究較多, 而對再生水的輸配管網的研究卻很少.
為了了解“紅水”的產生過程及不同流態對其產生的影響, 本文采用腐蝕性較強的再生水為實驗用水, 在中試不帶內襯的鐵管管網平臺上模擬單向連續流動和密閉循環流動兩種流態模式的供水過程, 連續監測模擬管網水質, 并在中試模擬平臺上觀察到“紅水”現象.同時, 采用XRD結合XPS分析“紅水”中顆粒物的特征, 為解釋再生水管網中爆發“紅水”事件提供依據.最后探討管網中出現“紅水”的原因, 以期為控制管網再生水水質穩定性提供依據參考.
2 材料與方法
2.1 管網中試平臺的搭建
中試管網模擬系統平臺(圖 1)由無內襯鑄鐵管、彎頭、循環泵、緩沖水箱、補水泵組成.管道長120 m, 內徑為100 mm, 循環泵及緩沖水箱均為不銹鋼材質, 緩沖水箱的體積為30 L, 可以緩沖水頭對循環泵的沖擊作用, 循環泵流量范圍為40~60 m3·h-1, 補水泵用于向管網中注水.實驗時, 循環泵可以保持水在管道中穩定循環流動, 補水泵一直開啟能保持管網中的水壓恒定, 并在取水樣后自動對管網進行補水, 保持管網滿流狀態.
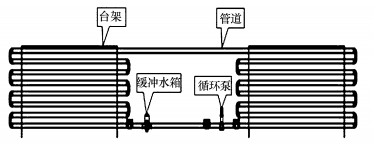
圖 1管網中試模擬系統平臺
2.2 實驗原水
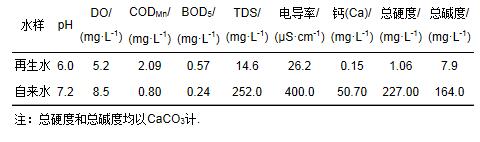
本試驗用水為北京某再生水廠出廠水, 該再生水廠以污水處理廠二級出水作為原水, 使用微濾結合反滲透工藝深度處理污水廠出水得到高品質再生水.此工藝生產的再生水實測水質和當地自來水水質比較結果見表 1, 可以看出, 此再生水pH值較低, 而CODMn、BOD值高于自來水, 其他指標都比較低.微濾和反滲透工藝去除了水中絕大部分的陰陽離子和懸浮物;再生水的CODMn和BOD值高于自來水是由于再生水原水中的有機物經雙膜處理后仍有少量殘留.
表 1 再生水與自來水水質比較
2.3 試驗系統的運行操作
依據管網的特征設計兩種實驗模擬實際網管供水過程, 即單向連續流動和密閉循環流動.平臺可以利用補水泵驅動實現低速單向流動, 也可以利用循環泵驅動實現高速循環流動.第一種模式為單向連續流動實驗, 啟動補水泵, 不啟動管道泵, 關閉管道上的一個蝶閥, 同時打開被關閉蝶閥對側管道最下端的排水閥, 使管道中的水從一端流入主體管道, 流經120 m所有管程, 在另一端最底端管道折彎處的排水閥流出, 補水泵會持續為主管道系統補水, 使管道中的水處于滿流狀態, 連續流動實驗時間為10 d, 定時取樣, 監測水質的數據變化, 補水泵的流量為3 m3·h-1, 水的流速為0.03 m·s-1, 水在管道中的停留時間為1 h左右.第二種模式為密閉循環流動實驗, 當系統管道注滿后, 打開管道上的兩個蝶閥, 使管道形成閉合的循環回路, 開啟管道泵, 開啟補水泵保持管道的壓力.取樣間隔為0 h、1 h、2 h、4 h、8 h、16 h、1 d、2 d、3 d…, 模擬足夠長的水齡, 不同時刻測試得到的水質參數反映出水質的變化情況, 管道泵的流量為40 m3·h-1, 管道壓力為150 kPa, 水的流速為1.2 m·s-1, 水在管道中的停留時間為96 h左右.
2.4 水質指標測定方法
pH值、溶解氧、TDS、電導率采用多功能水質分析儀檢測(哈納沃德), 總堿度采用酸堿指示劑滴定法測定, 總硬度采用EDTA滴定法測定, 總鐵采用電感耦合等離子光譜發生儀(ICP-EOS)測定.鐵管出水中同時存在顆粒物和鐵離子, 顆粒物不溶于水, 直接影響水的色度和濁度, 而水中的部分鐵離子也會吸附在顆粒物表面, 因此, 在對水中的鐵濃度進行ICP測定之前需要對樣品進行預處理, 對于溶解性鐵采用加硝酸的方式將水樣的pH調至1左右, 使吸附在顆粒物表面的鐵離子溶解, 再使用0.45μm的濾膜過濾進行測定;而對于總鐵的測定采用常溫消解的方法將水中的顆粒物完全溶解成為鐵離子, 再使用0.45μm的濾膜過濾進行測定.
3 結果與討論
3.1 再生水水質的化學穩定性分析
為評價該廠再生水水質的化學穩定性和腐蝕性, 采用Langelier飽和指數(LSI)、Ryznar穩定指數(RSI)、碳酸鈣沉淀勢CCPP(Calcium Carbonate Precipitation Potential)對此再生水進行判別, 具體測定方法和計算方法見參考文獻, 其化學穩定性情況如表 2所示.
表 2 再生水化學穩定性概況
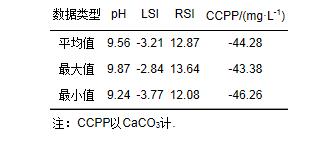
多次檢測實驗用水的LSI指數均小于0, 且平均值為-3.21, 說明水中的碳酸鈣為未飽和狀態, 具有強烈的溶解傾向;RSI指數都大于9.0, 平均值為12.87, 表明該水質的腐蝕性是極為嚴重的;而CCPP指數的平均值為-44.28 mg·L-1, 遠遠小于-10 mg·L-1, 同樣說明該水質具有極強的腐蝕性.
3.2 不同流動實驗出水水質參數的變化
3.2.1 常規水質指標的變化
圖 2顯示了兩種實驗所產生的“紅水”現象和干燥的顆粒物粉末形態.從圖中2a、2b可以看出, 循環流動實驗的水質比較污濁, 大量懸浮顆粒使清澈的再生水變成“黑水”.圖 2A、2B中單向連續實驗的水質較為清澈, 但水中有細小的紅色顆粒物.

圖 2兩種實驗過程與鐵溶出顆粒物的狀態(a、b、c代表密閉循環流動實驗, A、B、C代表單向連續流動實驗, a、A.實驗過程, b、B.實驗出水, c, C.干燥的鐵溶出顆粒物)
圖 3為單向連續流動實驗鑄鐵管出水常規水質參數隨時間的變化情況.從圖 3可以看出, 在10 d的單向連續流動實驗過程中, 模擬鑄鐵管網出水pH范圍為6.0~6.4, 略高于出廠水;溶解氧的濃度范圍為2.0~3.2 mg·L-1, 低于出廠水, 說明在流經120 m長的鑄鐵管后, 水中的溶解氧有消耗;水的TDS與電導率大致成正比關系, TDS和電導率呈現一致的變化趨勢, 都略大于出廠水.TDS和電導率的增加與管壁腐蝕層的鐵溶出有關, 鐵溶出導致了水中的亞鐵或鐵離子濃度的增加, 亞鐵或鐵離子是影響水的TDS和電導率變化的主要因素.
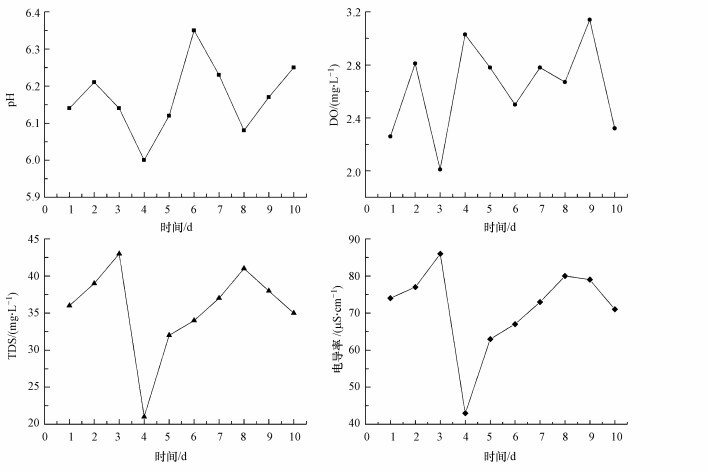
圖 3單向連續流動實驗水質參數變化
圖 4為密閉循環流動實驗中鑄鐵管出水水質的變化情況, 在前8 h再生水pH迅速上升, 從6.14上升到6.90左右, 而后緩慢下降, 并且維持在6.80左右, 趨于恒定;溶解氧濃度也是在前8 h迅速下降, 最后降至0.5 mg·L-1以下, 表明密閉循環實驗水中的溶解氧被全部消耗;TDS和電導率都在實驗前8 h迅速升高, 最后達到穩定, TDS與電導率的穩定值分別為55 mg·L-1和110μS·cm-1, 遠遠高于出廠水.
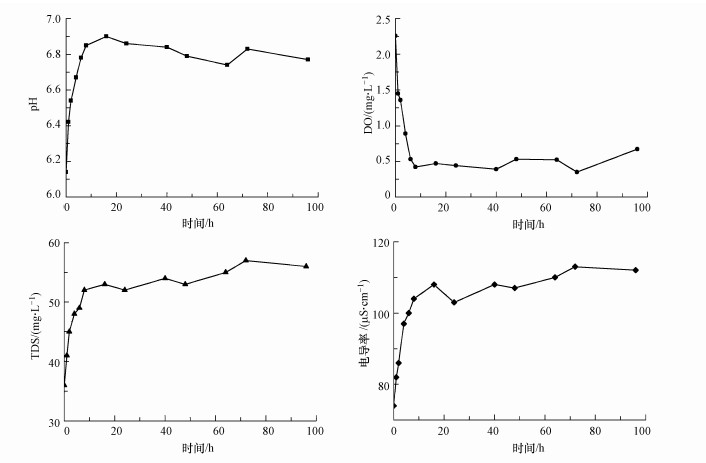
圖 4密閉循環流動實驗水質參數的變化
3.2.2 鐵濃度的變化
鐵溶出是影響水質的主要因素, 也是產生“紅水”現象的重要根源, 水的顏色與鐵的含量及形態有關, 通常情況, 當水中總鐵的濃度大于0.3 mg·L-1時, 管網可能產生“紅水”現象.實驗監測了水中鐵濃度的變化, 結果如圖 5所示.
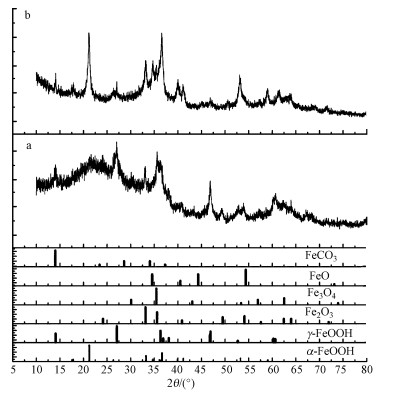
圖 5單向連續流動實驗中總鐵(a)及密閉循環流動實驗中總鐵和溶解性鐵(b)的變化
連續監測在單向連續流動實驗管網出水, 發現總鐵濃度比較高, 總鐵濃度均高于0.3 mg·L-1, 平均值為0.6 mg·L-1, 出現輕微的“黃水”現象, 管網出水中的鐵則主要來源于管壁腐蝕垢層的緩慢釋放.密閉循環流動實驗則出現了嚴重的“黑水”現象, 水中的溶解性鐵和總鐵的平均值分別高達20 mg·L-1和50 mg·L-1, 管壁上大量顆粒物被水流沖刷到了水中, 在8 h鐵溶出達到了平衡, 這與水質參數的變化規律一致.說明水質參數變化與鐵溶出有著密切的聯系, 在這種模式的實驗過程中, 由于其管壁的腐蝕層較薄, 管垢易因外力擾動脫落, 管網出水中的鐵來源于管壁上腐蝕產物的連續釋放.從圖 2可以看出, 在不同的流動狀態產生的“紅水”的顏色不同, 在密閉循環流動實驗中, 由于水流循環速度可以達到1.2 m·s-1, 水流對管壁的沖刷作用力比較大, 管壁上產生的腐蝕顆粒物會直接進入的水中引起比較明顯的“紅水”現象;而在單向連續流動實驗當中, 水流的速度相對比較緩慢(0.03 m·s-1), 水中的顆粒物會在管道上蓄積, 在透明的塑料軟管形成了紅色的沉淀物附著在管壁上.在兩種實驗過程獲得的顆粒物顏色也不相同, 密閉循環流動實驗中得到的顆粒物為土黃色, 而單向連續流動實驗中得到的顆粒物為褐紅色, 盡管顆粒物的顏色不相同, 但顆粒物的粒徑大致相同, 為0.005~0.01 mm, 這與相關文獻報道是一致的.通過兩種模式的實驗對比發現, 表面“紅水”的發生與水流對管壁上腐蝕層的作用力有直接聯系.
3.3 不同實驗“紅水”的鐵形態分析
為了進一步了解顆粒物的特征, 對兩種顆粒物進行了物相分析、化學成分及價態分析, 對兩種顆粒物進行XRD試驗, 測定兩種不同顏色的顆粒物的晶體結構組成, 結果如圖 7所示.鐵的腐蝕產物主要包括α-FeOOH、γ-FeOOH、FeCO3、Fe2O3、Fe3O4及FeO, 但兩種實驗方式所形成的腐蝕產物的成分差別較大.其中, 密閉循環流動實驗的顆粒物中FeOOH含量較多, 而且α-FeOOH的特征峰強度大于γ-FeOOH, 說明該模式下顆粒物中的α-FeOOH多于γ-FeOOH, 這是由于溶解氧存在的原因, 在有氧的情況下, α-FeOOH更容易形成.而單向連續流動實驗的顆粒物中FeCO3的含量比較多, 這與水中的溶解二氧化碳有一定關系.通過XPS試驗對兩種顆粒物進行了定量分析, 考察了在兩種顆粒物中不同價態鐵的腐蝕產物含量(圖 8)

圖 7兩種鐵溶出顆粒物的XRD圖譜(a.單向連續流動實驗, b.密閉循環流動實驗)
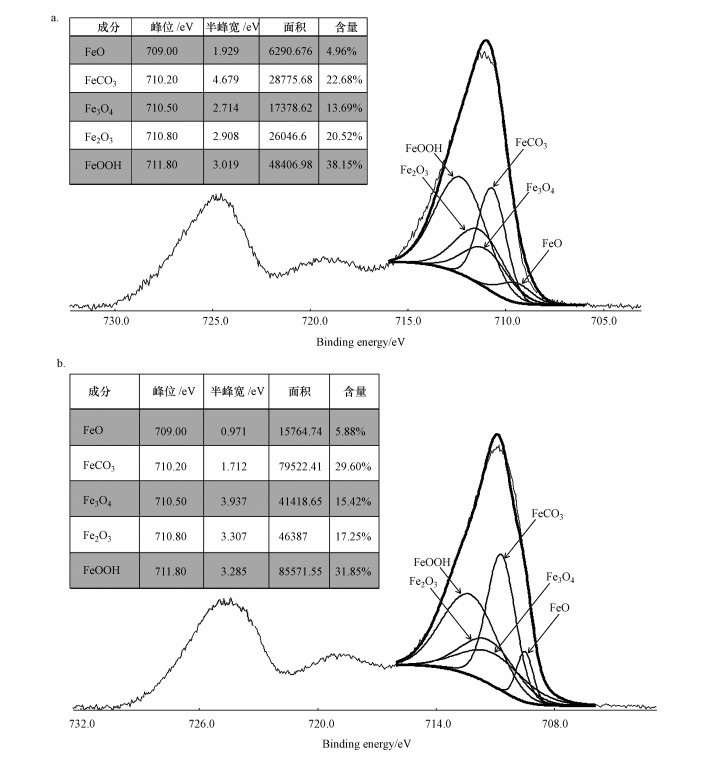
圖 8單向連續流動實驗(a)和密閉循環流動實驗(b)鐵溶出顆粒物XPS圖譜
通過對兩種顆粒物的定量分析表明, 顆粒物中羥基氧化鐵與碳酸亞鐵是最主要的成分, 也是三價鐵和二價鐵的主要存在形式.但兩種價態鐵的化合物含量有較大的不同, 其中, 單向連續流動實驗的土黃色顆粒中羥基氧化鐵與碳酸亞鐵的含量分別為38.15%和22.68%;而密閉循環流動實驗的褐紅色顆粒中羥基氧化鐵與碳酸亞鐵的含量分別為29.60%和31.85%.顆粒物的顏色可能會與羥基氧化鐵和碳酸亞鐵的含量有關, 也表明了不同“紅水”現象經歷了不同的物理化學過程.在兩種實驗條件下顆粒物中鐵的氧化物(氧化亞鐵、氧化鐵、四氧化三鐵)的總含量很接近, 分為39.17%和38.55%, 水中的鐵氧化物主要來源于羥基氧化鐵與碳酸亞鐵失水條件下的轉化, 因此, 在兩種顆粒采用相同的干燥過程所產生鐵的氧化物含量是相同的.說明在同一水質情況下, 鐵的腐蝕過程是相似的.
3.4 兩種實驗方式鐵釋放及水質轉化探討
無論是單向連續流動實驗還是密閉循環流動實驗, 管網出水呈現出一定的“紅水”現象, 水質參數pH、TDS、電導率、溶解氧都有變化, 雖然產生的顆粒物有一定差別, 但顆粒物的產生及鐵腐蝕與水質參數pH、溶解氧及堿度是相關的, 并影響“紅水”產生的過程.通過水質參數的變化可以確定兩種實驗方式情況下顆粒物產生的過程.
3.4.1 單向連續流動實驗顆粒物形成的模式
由于本實驗采用的再生水的堿度(7.9 mg·L-1)、硬度(10.6 mg·L-1)很低, 再生水中的重碳酸根含量比較低.然而本次實驗的補水水箱不是密閉的, 因此, 空氣中的二氧化碳會源源不斷地在水中的溶解形成碳酸(H2CO3), 而碳酸是弱酸, 它的解離程度很弱, 其在水中的解離分兩步:一級解離(式(1))和二級解離(式(2)).
(1)
(2)
而該模式下生成顆粒物的反應可以用Sontheimer等提出的管網鐵腐蝕過程的碳酸亞鐵模型(Siderite Model)來描述, 共分為3級, 其中, 初級反應:
(3)
(4)
二級反應:
(5)
(6)
(7)
三級反應:
(8)
(9)
(10)
在初級反應過程中, 金屬鐵在電化學的作用下會在陽極失去電子生成Fe2+, 同時一部分溶解氧在陰極會得到電子被還原生成OH-, 而且溶解二氧化碳會在水中不斷電離生成CO32-;由于該再生水的硬度很低, 水中的Ca2+不能夠產生碳酸鈣沉淀, 而在二級反應過程中CO32-可以與Fe2+結合生成FeCO3沉淀, Fe2+也可直接被溶解氧氧化生成FeOOH, 另外, 水中的OH-也會與Fe2+生成Fe(OH)2.上述反應過程既可在管壁界面上進行從而使生成的FeCO3和FeOOH沉積在管壁上, 也可在水相中進行造成總鐵濃度、TDS和電導率升高.這些反應能解釋連續流動實驗中鐵腐蝕現象所造成的總鐵濃度升高、溶解氧濃度降低及低堿度情況下生成顆粒物中FeCO3含量較高的原因.從第三級反應可知, 二級反應階段生成的FeCO3會進一步氧化成Fe3O4, 而FeOOH與Fe(OH)2會失水產生Fe2O3和FeO, 第三級反應是顆粒物中鐵的氧化物生成的過程.隨著試驗的進行, 系統穩定后, 出水pH值基本變化不大, 且略大于進水.這可能是由于管壁上逐漸積累了較多的腐蝕產物后上述各種反應速度減緩, 而腐蝕過程生成的OH-部分進入水相導致出水pH值升高.
3.4.2 密閉循環流動實驗顆粒物形成的模式
在密閉循環流動實驗中, 水在模擬管網中循環流動, 空氣中二氧化碳不會進入到密閉的管道系統中, 因此, 該實驗過程中消耗的碳酸根為進水中自身堿度所提供的.在密閉的管網系統中, 水中的溶解氧被迅速消耗, 在達到穩定狀態后, 系統中處于無氧狀態.在該模式下生成顆粒物的反應除了包括上述的碳酸亞鐵模型過程, 還包括無氧條件下鐵的腐蝕與釋放, Kuch提出, 在缺氧的條件下, 管壁上原先存在的三價鐵化合物會作為電子受體與金屬鐵發生如下反應:Fe+2FeOOH+2H+→3Fe2++4OH-, 使得鐵的腐蝕反應能夠繼續進行, 致使在密閉循環流動實驗過程中發生了嚴重的“紅水”現象, 導致水中的總鐵和溶解性鐵濃度加劇上升, 因此, 在缺氧的情況下, 更容易導致紅水現象發生, FeOOH分解也致使出水的pH也明顯升高.
兩種實驗分別模擬了管網中單向流和循環流的供水情況, 結果表明, 在不同管網模式產生“紅水”的情況及管壁腐蝕物的物相有明顯的區別, 在環狀管網中, 水中的溶解氧會快速的消耗, 無氧情況下的腐蝕是環狀管網的主要形式, 腐蝕產物中FeOOH占的比例較高;而在枝狀管網或末端管網中, 雖然水中的CO2與溶解氧會不斷消耗, 但空氣中CO2與O2對水體進行補充, 維持原有的平衡, 溶解氧和CO2均對鐵管腐蝕的貢獻都比較大, 腐蝕產物中FeCO3含量會高一些, 通過對比可知, 循環流態管網中比單向流態管網更容易發生“紅水”現象。
4 結論
1)本次實驗的再生水pH值在9.56左右, RSI指數在12.08以上, LSI < 0, CCPP指數遠遠小于-10, 該水質總體上屬于腐蝕性極強水質.
2)在鑄鐵管網中模擬了單向流和循環流兩種供水模式, 兩種實驗方式的出水水質都發生了明顯變化;出水水質的pH、TDS、電導率及總鐵都有明顯的升高, 說明不帶內襯的鑄鐵管不適合作該再生水的輸水管材.
3)在兩種實驗模式下得到了不同顏色、但粒徑相同的腐蝕顆粒物, 通過XRD、XPS分析發現, 兩種顆粒物中都包括α-FeOOH、γ-FeOOH、FeCO3、Fe2O3、Fe3O4及FeO, 但顆粒中羥基氧化鐵與碳酸亞鐵的含量有所不同, 而顆粒物中鐵的氧化物的總含量很接近.
4)管網中水的循環流比單向流更容易發生“紅水”現象, 顆粒在水中存在的狀態和流速有一定關系.
上一篇:如何去除印染廢水中的碳、氮、硫
下一篇:提高降解垃圾滲濾液的方法